Les caractéristiques du paysage et du microhabitat déterminent l’abondance des petits mammifères dans les parcelles forestières des paysages agricoles [PeerJ]
![Les caractéristiques du paysage et du microhabitat déterminent l’abondance des petits mammifères dans les parcelles forestières des paysages agricoles [PeerJ]](https://guidesurvie.com/wp-content/uploads/2022/01/Les-caracteristiques-du-paysage-et-du-microhabitat-determinent-labondance-des.jpg)
introduction
Le changement d’utilisation des terres, l’intensification des pratiques agricoles, la fragmentation des habitats naturels et l’altération des communautés biologiques qui en résulte conduisent à un déclin généralisé de la biodiversité des terres agricoles, mesurée à travers de nombreux taxons différents (Batary et al., 2020; Benton, Vickery & Wilson, 2003; Geiger et al., 2010; Kleijn et al., 2011). Dans les paysages agricoles, une tâche principale pour la conservation de la biodiversité des terres agricoles et des services écosystémiques associés est la compréhension des relations entre les caractéristiques de l’habitat, la configuration de l’habitat et la dynamique des populations d’espèces (Fahrig, 2007; Le Roux et al., 2008; Tscharntke et al., 2005). La nécessité de préserver et d’améliorer la diversité des paysages agricoles passant par gestion des habitats non cultivés (c’est à dire., marges des champs, boisés, haies et prairies pérennes) pour soutenir des niveaux élevés de biodiversité agricole est largement confirmé (Carvell et al., 2011; Dainese et al., 2015; Dainese et al., 2016; De Simone, Sigura & Boscutti, 2017).
Les petites parcelles de forêt peuvent fournir plusieurs services écosystémiques importants à la société humaine, mais elles reçoivent peu d’attention par rapport aux grands écosystèmes forestiers. En particulier, les petites parcelles forestières représentent des éléments centraux dans le conflit de longue date entre le besoin de productions agricoles et la conservation biologique (Biber et al., 2015; Benayas, Bullock & Newton, 2008).
Dans une revue récente, Decocq et al. (2016) axé sur les services écosystémiques fournis par de petites parcelles forestières de paysage agricole mettant en évidence leur potentiel à soutenir la biodiversité à la fois in situ (patch boisé) et dans la zone de proximité améliorant la connectivité du paysage. Ici, les caractéristiques structurelles des patchs (pH du sol, disponibilité des nutriments, lumière) et les modèles de configuration de l’habitat (c’est à dire., taille des parcelles forestières, isolement des parcelles) ont été définis comme des facteurs déterminants de la richesse en espèces internes et de la composition de la communauté.
Les rongeurs et autres petits mammifères sont rarement la cible d’études de conservation car ils sont souvent considérés comme un ravageur ou une menace pour la production (Brown et al., 2007; Butet, Paillat & Delettre, 2006; Dickman 1999 ; Putman, 1989), donc associée à des impacts négatifs sur les activités humaines (Capizzi, Bertolino & Mortelliti, 2014). Cependant, les petits mammifères sont essentiels à d’importantes fonctions écosystémiques (Dickman 1999). Ils contribuent à l’aération du sol (Laundre & Reynolds, 1993) et jouent un rôle important en tant que consommateurs de mauvaises herbes et d’insectes (Briqueteur, Pearson & Maron, 2010; Gliwicz & Taylor, 2002). Les petits mammifères sont cruciaux pour la dispersion des diaspores des plantes (Bogdziewicz et al. 2020 ; Steele, Wauters & Larsen, 2005) et les champignons (Capizzi & Santini, 2007; Sieg, 1987). Dans plusieurs écosystèmes, ils soutiennent les chaînes alimentaires, représentant la principale biomasse de proies pour plusieurs groupes de prédateurs, tels que les oiseaux, les reptiles et les mammifères (Martin, 1994; Salamolard et al., 2000; álek et al., 2010) et contribuent grandement à la complexité globale des réseaux trophiques (Butet & Leroux, 2001; Korpimaki & Norrdahl, 1991). Par exemple, il a été prouvé que les faibles densités de proies affectent les densités de nidification des rapaces dans les paysages agricoles (voir par exemple., Michel, Burel & Butet, 2006).
Les populations de certaines espèces de petits mammifères ont connu un déclin, parfois drastique, probablement du fait de l’intensification de l’agriculture (Macdonald et coll., 2007; Palmeirim, Santos-Filho & Peres, 2020), agissant à la fois au niveau du paysage et au niveau des parcelles. En particulier, il a été démontré que l’intensification des paysages agricoles diminue la densité d’espèces rares et sténoïques au profit d’espèces généralistes (Burel et al., 2004; Gentili, Sigura & Bonesi, 2014; Millàn de la Peña et al., 2003), provoquant des réponses idiosyncratiques. Par example, Silva, Hartling & Opps (2005) et Serafini, Priotto & Gomez (2019) ont trouvé que la complexité structurelle (par exemple., la couverture et la forme des parcelles de forêt) et l’hétérogénéité du paysage (par exemple., différentes couvertures d’utilisation des terres) ont favorisé la diversité des espèces de petits mammifères. D’autre part, Michel, Burel & Butet (2006) ont démontré que, dans les zones où les utilisations des terres sont relativement homogènes (moins d’hétérogénéité du paysage), l’uniformité des espèces, mais pas la richesse des espèces, était affectée négativement par l’intensification de l’intensification de l’utilisation des terres agricoles. À l’échelle de la parcelle, caractéristiques du tapis forestier, présence de débris ligneux grossiers, végétation de sous-étage, composition de la canopée (Carey et Harrington, 2001), âge de la forêt, complexité de la végétation (Pearce & Venier, 2005), présence de bois mort (grumes et troncs pourris) et structure de litière (Cox, Dickman & Cox, 2000; Kemper & Bell, 1985; Marsh et Harris, 2000; Simonetti, 1989; Szymanski et al., 2020; Yahner, 1986) peut également influencer la présence de petits mammifères. Une complexité élevée du microhabitat grâce à une grande diversité d’arbustes, une couverture végétale élevée et un faible pourcentage de sol couvert de sol nu sont connus pour augmenter l’abondance globale des petits mammifères et la richesse en espèces (Gelling, Macdonald et Mathews, 2007; Silva & Prince, 2008; Szymanski et al., 2020).
La plupart des études précédentes ont mis en évidence un effet important des facteurs environnementaux sur les petits mammifères. Néanmoins, les évaluations complètes à plusieurs échelles écologiques sont encore rares et se concentrent sur l’autécologie des espèces. Dans cette optique, comparer des espèces aux comportements différents (c’est à dire., généraliste vs spécialiste) devraient être encouragés à obtenir de nouvelles connaissances sur la future gestion des paysages agricoles.
Dans cette étude, nous avons étudié les effets des caractéristiques environnementales sur l’abondance des petits mammifères en accordant une attention particulière aux spécialistes des forêts et aux espèces généralistes de l’habitat. Nous avons considéré trois échelles écologiques différentes : le microhabitat, l’habitat (patch) et le paysage. En particulier, nous avons testé les effets de la composition et de la configuration du paysage, de la structure forestière et des caractéristiques du sol forestier sur deux espèces de petits mammifères (c’est à dire., Apodemus sylvaticus, et A. agrarius) dans des vestiges de végétation ligneuse le long d’un gradient d’intensification d’utilisation des terres agricoles. Ces essences ont été choisies car elles représentent des essences typiques des boisés de plaine, très communes dans la zone d’étude (Dorigo, 2018) et peut facilement être capturé avec des systèmes de capture en direct.
Plus précisément, nous posons deux questions : (1) Quels sont les effets relatifs et indépendants de l’hétérogénéité des éléments, de la composition et de la configuration du paysage sur l’abondance des petits mammifères dans les boisés au sein des paysages agricoles ? (2) L’effet de ces propriétés de mosaïque diffère-t-il entre les espèces ayant des besoins écologiques différents ?
Nous nous attendions à trouver une forte interaction entre la composition du paysage et les caractéristiques de l’habitat pour déterminer la répartition et l’abondance des espèces de petits mammifères. En particulier, nous nous attendions à trouver des réponses contrastées entre les espèces considérées, faisant l’hypothèse que le généraliste A. sylvaticus pourraient être plus affectées par la composition et la configuration du paysage que par les caractéristiques forestières locales.
Matériels et méthodes
Zone d’étude, espèces et plan d’échantillonnage
L’étude a été menée dans le paysage agricole de la région du Frioul-Vénétie Julienne, au nord-est de l’Italie (45°56′N, 12°47′E), une vaste zone de plaine (de 20 à 36 m d’altitude) de dépôts alluviaux (Fontana, 2006). Dans la zone d’étude, une matrice de champs cultivés intensivement de cultures annuelles (céréales d’hiver, Zea mays, et Glycine max) et la plantation permanente (peupliers et vergers) est interrompue par de petites haies et des boisés.
Deux espèces de petits mammifères ont été considérées. Apodemus sylvaticus (Linnaeus 1758) est une espèce généraliste et opportuniste de l’habitat avec une grande capacité de dispersion; il peut occuper tous les boisés et haies, se déplaçant fréquemment entre les parcelles (Bauchau & Le Boulengé, 1991; Fuentes-Montemayor et al., 2020). Son régime alimentaire principal comprend des graines, des fruits, des parties vertes de plantes et des champignons, mais la composante animale ne peut être substantielle qu’à certaines périodes de l’année (Canova et Fasola, 1993; Hansson, 1985). Apodemus agrarius (Pallas 1771) est une espèce hygrophile qui se nourrit d’aliments riches en calories d’origine animale et végétale (Babińska-Werka & Garbarczyk, 1981). Son régime alimentaire est assez varié et comprend une large gamme d’invertébrés et de plantes (Babinska-Werka, 1981), sous forme de graines et de parties vertes (Babinska-Werka, 1981). Dans le nord de l’Italie, l’espèce est généralement présente à basse altitude, à la lisière des bois mésophiles et sur les berges des rivières forestières (Zulian, 1987).
Les sites d’échantillonnage étaient 19 parcelles boisées restantes non récoltées au cours des trois dernières années, caractérisées par des sols moyennement humides et d’une superficie inférieure à 8 ha. Les parcelles ont été sélectionnées le long d’un gradient d’intensification paysagère allant de 5 % à 33 % d’habitats semi-naturels avec une zone tampon de 500 m autour de chaque parcelle. La taille de la zone tampon a été établie en accord avec la mobilité des espèces de petits mammifères les plus abondantes trouvées (Liro & Szacki, 1987). La même distance a été supposée pour considérer les parcelles d’échantillonnage comme indépendantes les unes des autres. Les parcelles distantes de moins de 500 m les unes des autres n’ont été considérées que si elles sont séparées par des barrières (c’est à dire., cours d’eau de plus de 5 m de large et d’un mètre de profondeur).
Collecte de données
Échantillonnage de petits mammifères
Comme méthode de piégeage, nous avons utilisé des pièges Sherman (type LFA : cm 8 × 9 × 24. H.B. Sherman Traps©). Cette méthode de capture a tendance à être sélective car elle piège principalement des petits mammifères pesant au moins 5 grammes comme les muridés (c’est à dire., Apodemus, Mus, et Rattus dans la zone d’étude) (Caceres, Naples & Hannibal, 2011; Umetsu, Naxara & Pardini, 2006). Elle empêchait donc la capture de petits mammifères insectivores. Dans chaque parcelle d’échantillonnage, 10 pièges Sherman, espacés de 10 m les uns des autres, ont été placés le long d’un transect linéaire de 100 m. Les pièges étaient appâtés avec des morceaux de graines fraîches de pomme et de tournesol (Tallmon & Mills, 1994), pour assurer la survie des animaux piégés et ont été activés pendant quatre nuits consécutives. Les échantillonnages pendant les périodes de précipitations excessives ont été exclus pour éviter une mortalité excessive des animaux. Pour améliorer le contrôle de la température, chaque piège a été tapissé au fond d’un matériel végétal sec particulièrement important pendant la saison froide.
Dans toutes les zones (sites), quatre sessions d’échantillonnage ont été répétées d’avril 2013 à octobre 2014. Les pièges ont été vérifiés une fois par jour le matin. Les animaux ont été piégés par la méthode CMR (Catch-Mark-Recapture). Chaque individu a été marqué avec une étiquette d’oreille (Opivi Brand®), et son espèce, sa masse corporelle, son sexe et son âge (classes d’âge juvénile, subadulte et adulte) ont été enregistrés. Les animaux ont été relâchés à nouveau au même endroit où ils ont été piégés. Les activités de piégeage ont été autorisées par l’Institut italien pour la protection et la recherche de l’environnement (ISPRA) (Aut. PG/Ir Rif. Int. 26358-28967/2013) et par la région Friuli Venezia Giulia (Aut. Prot. SCPA/12.5/17552- 2013).
Caractéristiques de la structure du microhabitat
Les caractéristiques du microhabitat ont été mesurées dans des sous-échantillons placés le long des transects linéaires avec des pièges vivants (selon Amori et al., 2015). Autour de chaque piège, la couverture végétale a été évaluée dans une zone tampon de 5 m. En particulier, le pourcentage de couverture de la couche herbacée, du sol rocheux, du sol nu, de la litière de feuilles et des débris ligneux grossiers (en considérant même les petits dépôts de matériau également d’un diamètre <3 cm) a été estimé visuellement en tant que pourcentage de couverture (Amori et al., 2015).
Enfin, la composition de la litière a été évaluée, en estimant le pourcentage des catégories : litière non décomposée (feuilles entières) ; litière partiellement décomposée (feuilles partiellement dégradées mais structure foliaire encore reconnaissable); litière dégradée (structure foliaire non reconnaissable) dans la strate de la litière. Cela a été effectué par deux opérateurs simultanément autour de chaque piège, et les résultats ont été moyennés.
Caractéristiques de la structure en bois
À l’échelle de la parcelle, la présence de bois mort, la stratification du sous-étage, le diamètre des arbres, les espèces ligneuses et sous-bois et la présence d’espèces d’arbres et d’arbustes non indigènes ont été évalués.
Bois morts
Le bois mort a été mesuré au printemps 2015 suivant principalement le protocole de Bianchi et al. (2013). Nous avons mesuré avec un pied à coulisse les diamètres de toutes les bûches (par exemple., tiges, branches) (si > trois cm). La longueur de l’échantillon et l’état de décomposition ont également été recodés. Nous avons utilisé la méthode d’échantillonnage à zone fixe (FAS) (Harmon & Sexton, 1996), considérée comme plus fiable que d’autres méthodes, en particulier avec une grande quantité de nécromasse composée de petits fragments (Bianchi et al., 2013; Warren et Olsen 1964). Des mesures de bois mort ont été effectuées dans la partie centrale de la forêt le long du transect utilisé avec des pièges à petits mammifères, autour des pièges 2, 5 et 8 de chaque transect.
Autour des pièges sélectionnés, un rayon de 5 m (78,5 m2) a été interrogé. Nous avons opté pour un seuil inférieur à celui indiqué par Bianchi et al. (2013), car les boisés étudiés sont d’origine récente et le bois mort est souvent composé de grumes de petite taille. Les branches et fragments ligneux de diamètres inférieurs à trois cm n’ont pas été pris en compte dans ce protocole mais ont tout de même été évalués comme des microhabitats potentiels (voir Microhabitat, ci-dessus). Chaque journal (par exemple., tiges, branches) de diamètre > trois cm a été mesurée (longueur, grand rayon, petit rayon) et rapportée à l’une des trois catégories de l’échelle suivante : (i) bois mort sur pied, bois mort nouvellement formé, avec grumes sur pied (Marsh et Harris, 2000); (ii) bois mort moulu, bois mort au sol; (iii) bois mort pourri, bois mort avec tissu ligneux spongieux et imbibé d’eau.
Le volume de bois mort a été calculé en utilisant l’équation suivante. (1): (1)
où V est le volume, h est la hauteur/longueur, R est le rayon principal, r est le rayon mineur (Harmon & Sexton, 1996). Les valeurs totales du bois mort, pour chaque stade, ont ensuite été moyennées entre les trois FAS considérés pour chaque station d’échantillonnage.
Densité d’arbustes de sous-bois
Nous avons mesuré la capacité de renouvellement et la stratification verticale de la couche de sous-bois des bois étudiés. En particulier, nous avons identifié, le long du transect utilisé avec les pièges pour les prélèvements de petits mammifères (autour du piège 2, 5 et 8 de chaque transect), des zones circulaires de 2 m de rayon (6,28 m2). Dans chaque zone, toutes les plantes ligneuses d’un diamètre inférieur à 7,5 cm ont été enregistrées, indiquant l’espèce et mesurant le diamètre de la tige au niveau du sol.
Densité et diamètre des arbres
Au centre du transect (piège 5), nous avons placé une parcelle de 10×10 m, à l’intérieur de laquelle nous avons noté le nombre de plantes ligneuses de plus de 7,5 cm de diamètre. Pour chaque plante nous avons rapporté l’espèce et le diamètre à hauteur de poitrine (D.B.H). Toutes les données ont finalement été regroupées en tant que diamètre moyen de chaque parcelle, en considérant leur écart type comme un proxy de la variabilité de la parcelle.
Présence d’espèces exotiques
Nous avons vérifié la présence de plantes arboricoles non indigènes dans les parcelles de 10 × 10 m (voir ci-dessus : Densité et diamètre des arbres) ainsi que la présence et le nombre de plantes arbustives non indigènes à l’intérieur des placettes de 2 m de rayon (voir ci-dessus : Densité d’arbustes de sous-bois).
Caractéristiques de la structure du paysage
L’utilisation des terres a été cartographiée dans deux zones tampons concentriques, respectivement de 500 m (0,785 km2) et 250 m (0,196 km2) rayons, autour des 19 boisés résiduels arpentés. Les types d’utilisation des terres ont été cartographiés à l’aide d’images aériennes de la zone d’étude (année 2014) dans un environnement open source de système d’information géographique (SIG) (QGIS). Les classes d’utilisation des terres cartographiées étaient (1) les terres arables, c’est à dire., cultures annuelles; (2) cultures permanentes, c’est à dire., vergers, vignobles et peupliers; (3) mettre de côté, c’est à dire., les jachères, les zones non cultivées avec un couvert herbacé et arbustif ; (4) bois, c’est à dire., haies et boisés; (5) implantations, c’est à dire., les zones urbaines, les zones industrielles et les bâtiments isolés. Les rivières et les routes n’étaient pas considérées comme des polygones mais mesurées comme des éléments linéaires (longueur).
La configuration du paysage a été analysée au moyen de métriques du paysage en tenant compte des caractéristiques à l’échelle de la parcelle et du paysage (composition et configuration). A cet effet, les variables sélectionnées (McGarigal & Marks, 1995) : superficie du boisé; périmètre boisé; Ratio périmètre-superficie du boisé (k =p/a); Indice de forme de patch (); Indice de proximité moyen pour toutes les parcelles du paysage (MPI) ; indice de proximité moyen pour les parcelles composant la classe de bois (MPI_Wood) ; Distance moyenne du plus proche voisin pour les parcelles comprenant la classe de bois (MNN) ; Indice d’interspersion et de juxtaposition pour les parcelles comprenant la classe des bois (IJI) ; Nombre total de parcelles de bois dans le paysage (NumP); Taille moyenne des parcelles pour les parcelles comprenant la classe de bois (MPS) ; Bordure totale pour les patchs comprenant la classe de bois (TE) ; Pourcentage de paysage occupé par chaque type de parcelle dans le paysage (PLAND); Indice de diversité de Simpson modifié basé sur Pielou (1975) modification de l’indice de diversité de Simpson (MSIDI). Les analyses de la structure du paysage ont été réalisées à l’aide du logiciel Fragstat (McGarigal, Cushman & Ene, 2012).
Analyses de données
La faible probabilité de recapture, et donc les estimations d’abondance peu fiables, ne nous ont pas permis d’utiliser des estimations d’abondance tirées de modèles de capture-recapture, c’est pourquoi un indice d’abondance a été utilisé. L’abondance de la population a été calculée par l’indice d’abondance relative (RAI), utilisé comme mesure indirecte de la densité de population (Cagnin et al., 1998; Klaa, Mill & Incoll, 2005; Ouin et al., 2000) selon la formule Eq. (2). (2)où s est le site d’échantillonnage, N est le nombre d’individus de chaque espèce, m est le nombre de nuits pendant lesquelles un piège est ouvert, et t est le nombre de pièges actifs.
Pour chaque site, 40 variables environnementales ont été mesurées, regroupées en structure du microhabitat (8), structure du bois (13), composition paysagère (6) et configuration paysagère (13). Toutes les analyses ont été effectuées à l’aide du logiciel statistique R (Équipe de base R, 2021).
Toutes les variables ont été initialement analysées et sélectionnées pour faire face à la (multi-)colinéarité et obtenir des modèles plus parcimonieux (Lointain, 2005). La colinéarité variable a été évaluée par l’analyse en composantes principales (ACP) et la corrélation de Pearson (Pearson’s r < 0.6), en utilisant le package « voiture » (Fox & Weisberg, 2011). Après cette sélection, 19 variables ont été retenues comme prédicteurs environnementaux, réparties en quatre groupes : (i) structure du microhabitat, c’est à dire., pourcentage de couverture de litière, pourcentage de débris ligneux grossiers, pourcentage de sol nu et pourcentage de litière non décomposée ; (ii) structure en bois, c’est à dire., nombre d’espèces d’arbres, DHP des arbres, densité d’arbres, densité d’arbustes, nombre d’espèces d’arbustes, bois mort total et bois mort pourri ; (iii) composition paysagère, c’est à dire., pourcentage de terres arables, de bois, de cultures permanentes, d’établissements et de jachère ; (iv) configuration paysagère, c’est à dire., rapport surface/périmètre, PSI et MPI_Wood.
L’inférence multi-modèle (MMI) dans un cadre théorique de l’information a été utilisée pour évaluer l’influence des variables environnementales sur l’abondance de Apodemus agrarius et A. sylvaticus, à différentes échelles (Burnham et Anderson, 2002). Cette technique compare l’ajustement de tous les modèles possibles (y compris le modèle nul) obtenu par la combinaison des variables avec la fonction « drague » dans le package MuMIn (Bartoń, 2015) du logiciel R. Nous avons utilisé le critère d’information d’Akaike (AIC) (Akaïké, 1973) pour choisir le modèle le mieux adapté. L’AIC mesure la qualité relative d’un modèle en tenant compte du compromis entre la complexité du modèle et la qualité de l’ajustement. Le meilleur ajustement est indiqué par la valeur AIC la plus faible (AIC MIN). Dans un ensemble de modèles chaque modèle (je) peut être classé en utilisant sa différence de score AIC par rapport au modèle le mieux adapté (Δ AICje = AICje- AICje MIN). Un modèle de l’ensemble peut être considéré comme plausible si son AIC est inférieur à 2 (Burnham et Anderson, 2002). Nous avons également dérivé le poids du modèle d’Akaike (wje) qui est la probabilité que le modèle (je) est le modèle le mieux adapté si les données ont été collectées à nouveau dans des circonstances identiques (Burnham et Anderson, 2002). Nous avons également calculé l’importance relative des variables en utilisant le poids du modèle d’Akaike.
Des modèles linéaires à effets mixtes (MLM) ont été utilisés pour estimer les paramètres du modèle, les résidus du modèle se rapprochant d’une distribution normale. Les modèles comprenaient l’abondance de la population comme variable de réponse et les espèces, les variables environnementales et leurs interactions comme effets fixes. L’ID du transect a été inclus comme effet aléatoire. En raison du faible nombre de répliques réelles, les quatre groupes de variables liés aux trois niveaux d’échelle (microhabitat, habitat, composition du paysage + configuration) ont été modélisés séparément. Un modèle global a été réalisé en utilisant uniquement les variables qui avaient un coefficient moyen significatif (p < 0.05) and a high Relative Variable Importance (RVI) value (RVI>0,7). Des LMM ont été menées pour chaque variable de réponse séparément en utilisant à la fois un modèle linéaire avec et sans inclure un terme quadratique pour tenir compte d’une éventuelle relation non linéaire. L’inférence multi-modèle basée sur l’AIC a été exécutée avec le package « MuMIN » (Bartoń, 2016). Les LMM ont été appliqués à l’aide du package « nlme » (Pinheiro et al., 2017). La qualité de l’ajustement du modèle a été davantage testée à l’aide de tracés de diagnostic des résidus et des indices de qualité (Lointain, 2005; Zuur et al., 2009).
Résultats
Dans toutes les sessions d’échantillonnage, 868 captures ont été enregistrées, dont 36,5% étaient des individus recapturés. L’effort de capture total était de 3024 nuits-pièges, avec un indice de capture (Ic = N × 100 captures / nuits-pièges) de 28,7. Parmi les captures, 55,3 % étaient représentés par A. agrarius, 40,1% d’A. sylvaticus, 4,1 % par Rattus norvegicus et les 0,5 % restants par R. rattus, Microtus arvalis et Crocidura suaveolens.
Apodemus sylvaticus a été capturé dans tous les sites d’échantillonnage alors que A. agrarius se sont produites dans 16 sites et, ensemble, ces espèces représentaient environ 95 % des individus capturés. Les deux espèces de rongeurs ont été capturées lors de toutes les sessions d’échantillonnage. Pour toutes les échelles étudiées, les modèles nuls ont montré un faible poids (poids <0.001) and were not considerable as plausible (delta AIC >12).
Structure du microhabitat
Pour la structure du microhabitat, l’inférence multi-modèle a montré que huit modèles étaient pris en charge (tableau 1). Les modèles comprenaient le pourcentage de bois mort, la couverture végétale du sol nu, le pourcentage de litière non décomposée, les espèces et leur interaction. La variable la plus importante était le pourcentage de litière non décomposée et son interaction avec les espèces (RVI > 0,70 ; p = 0,05). Bien que non significatives, la présence de bois mort et la couverture végétale du sol nu étaient également importantes (RVI = 0,71 et 0,68, respectivement), alors que leurs interactions avec les espèces étaient négligeables. En général, l’abondance des petits mammifères diminuait à mesure que la litière non décomposée augmentait. Les modèles expliquaient entre 27 et 29 % de la variation totale de l’abondance des petits mammifères.
Structure en bois
Pour le groupe de variables décrivant la structure du bois, l’inférence multi-modèle a montré qu’il y avait sept modèles plausibles, qui comprenaient la densité des arbres, le DHP, la richesse en espèces d’arbres, la richesse en arbustes, les espèces de petits mammifères et leurs interactions (tableau 2). Parmi ces variables, la densité des arbres, le nombre d’espèces d’arbres (et son interaction), le nombre d’espèces arbustives (et son interaction) ont montré une importance relative élevée (RVI>0,7), bien qu’aucune d’entre elles n’ait été significative. Les modèles expliquaient entre 20 et 28 % de la variation totale de l’abondance des petits mammifères.
Liste des modèles plausibles réalisés avec inférence multi-modèles pour la structure du microhabitat.
Les estimations sont rapportées : l’interception (Int), les variables considérées dans chaque modèle (ddW = pourcentage moyen de surface autour des pièges occupé par du bois mort ; grn = pourcentage moyen de surface autour des pièges occupé par le sol nu ; spcs = espèce ; und = pourcentage moyen de litière non décomposée dans la strate de litière), R2, AIC,AIC et le poids du modèle (wi). Les valeurs d’importance relative des variables et leur signification sont indiquées en gras.
| (Int) | ddW | grn | SPC | et | ddW:spcs | grn:spcs | spcs:und | R2 | AIC | delta | poids |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 126,7 | −0.25 | 0,03 | + | -1,30 | + | + | + | 0,29 | 344,6 | 0 | 0,11 |
| 127,5 | −0.26 | + | −1.31 | + | + | 0,29 | 344,9 | 0,31 | 0,10 | ||
| 127,4 | −0.26 | 0,00 | + | −1.31 | + | + | 0,29 | 345,4 | 0,87 | 0,07 | |
| 120 | 0,13 | + | -1,25 | + | + | 0,28 | 345,6 | 1.04 | 0,07 | ||
| 122.4 | + | -1,27 | + | 0,27 | 345,6 | 1.05 | 0,07 | ||||
| 111.3 | 0,33 | 0,26 | + | -1,17 | + | + | 0,28 | 345,9 | 1,38 | 0,06 | |
| 116,1 | 0,33 | + | -1,23 | + | 0,28 | 346,2 | 1,59 | 0,05 | |||
| 124,8 | −0.13 | + | -1,30 | + | 0,27 | 346,4 | 1,8 | 0,05 | |||
| 0,71 | 0,68 | 1 | 0,86 . | 0,46 | 0,44 | 0,72 . |
Liste des modèles plausibles réalisés avec inférence multi-modèles à l’échelle de la structure du bois.
Les estimations sont rapportées : l’intersection (Int), les variables considérées dans chaque modèle (Tree_dns = densité des arbres ; Mean_dmt = diamètre moyen du tronc ; Tree_spcs = nombre d’espèces d’arbres ; Shr_spcs = nombre d’espèces d’arbustes ; spcs = espèces), R2, AIC,AIC poids du modèle AIC et poids du modèle (wi). Les valeurs d’importance relative des variables et leur signification sont indiquées en gras.
| (Int) | Tree_dns | Mean_dmt | Arbre_spcs | Shr_spcs | SPC | Tree_dns : spcs | Mean_dmt : spcs | Tree_spcs: spcs | Shr_spcs : spcs | R2 | AIC | delta | poids | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 95,33 | 0,57 | -1,01 | −6.66 | −1.89 | + | + | + | + | + | 0,28 | 333,7 | 0 | 0,23 | |
| 75.24 | 0,94 | -6,98 | -2,90 | + | + | + | + | 0,22 | 334.1 | 0,36 | 0,19 | |||
| 94,61 | 0,60 | -1,01 | −6.66 | −1.85 | + | + | + | + | 0,28 | 334,8 | 1.1 | 0,13 | ||
| 84.17 | 0,77 | −0.45 | −6.8 | -2,45 | + | + | + | + | 0,24 | 334,8 | 1.11 | 0,13 | ||
| 106,4 | -1,06 | −6,74 | −2,56 | + | + | + | + | 0,26 | 334,9 | 1.21 | 0,12 | |||
| 78.33 | 0,77 | -7,01 | -3,13 | + | + | + | 0,22 | 335.2 | 1,46 | 0,11 | ||||
| 92,39 | -7,15 | -4,14 | + | + | + | 0,20 | 335,6 | 1,83 | 0,10 | |||||
| 0,75 | 0,66 | 0.99 | 0,95 | 1 | 0,48 | 0,42 | 0,9 | 0,83 |
Configuration paysage
L’analyse a été menée à la fois pour 500 m et 250 m.
À l’aide de variables de configuration du paysage dans des zones tampons de 250 m, trois modèles ont été pris en charge (tableau 3), qui comprenaient les variables suivantes : rapport superficie/périmètre, PSI, espèces. Le plus important, bien que non statistiquement significatif, était l’indice de forme de patch et son interaction avec les espèces (RVI>0,91). Les modèles expliquaient entre 6 et 11 % de la variation totale de l’abondance des petits mammifères.
Liste des modèles plausibles réalisés avec inférence multi-modèles pour la configuration du paysage dans une zone tampon de 250 m.
Les estimations sont rapportées : l’interception (Int), les variables considérées dans chaque modèle (Are_prm = rapport surface/périmètre des parcelles de bois, PSI = indice de forme des parcelles), R2, AIC,AIC et le poids du modèle (wi). Les valeurs d’importance relative des variables et leur signification sont indiquées en gras.
| (Int) | Are_prm | psi | SPC | Are_prm:spcs | PSI: spcs | R2 | AIC | delta | poids | |
|---|---|---|---|---|---|---|---|---|---|---|
| 38,7 | 3,52 | + | + | 0,06 | 342,9 | 0 | 0,45 | |||
| 26,01 | 0,43 | 5,17 | + | + | 0,1 | 343,7 | 0,83 | 0,3 | ||
| 32,87 | 0,2 | 4,28 | + | + | 0,11 | 344,1 | 1,19 | 0,25 | ||
| 0,55 | 0,99 | 1 | 0,25 | 0,91 |
En considérant les mêmes descripteurs à l’intérieur des tampons de 500 m, sept modèles plausibles ont été obtenus, incluant les variables : rapport superficie/périmètre, PSI, MSI, espèces et leurs interactions avec les variables (tableau 4). Dans ce cas également, aucune variable n’a montré une valeur RVI élevée (> 0,7), à l’exception du PSI (et de son interaction avec l’espèce). Le plus important, bien que non statistiquement significatif, était le PSI et son interaction avec les espèces (RVI>0,91). Les modèles expliquaient entre 6 et 26 % de la variation totale de l’abondance des petits mammifères.
Liste des modèles plausibles réalisés avec inférence multi-modèles pour la configuration du paysage dans une zone tampon de 500 m.
Les estimations sont rapportées : l’interception (Int), les variables considérées dans chaque modèle (Are_prm = rapport surface/périmètre des parcelles de bois, PSI = indice de forme des parcelles, MSI_500 = Indice de diversité de Simpson modifié dans une zone tampon de 500 m), R2, AIC,AIC et le poids du modèle (wi). Les valeurs d’importance relative des variables et leur signification sont indiquées en gras.
| (Int) | Are_prm | MSI_500 | psi | SPC | Are_prm:spcs | MSI_500 : pièces | PSI: spcs | R2 | AIC | delta | poids |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 38,7 | 3,52 | + | + | 0,06 | 342,9 | 0 | 0,19 | ||||
| −18,15 | 0,57 | 6,78 | + | + | + | 0,2 | 343,3 | 0,41 | 0,15 | ||
| 26,01 | 0,43 | 5,17 | + | + | 0,09 | 343,7 | 0,83 | 0,12 | |||
| −15,68 | −0,15 | 0,59 | 6,31 | + | + | + | + | 0,26 | 343,9 | 1,04 | 0,11 |
| 32,87 | 0,2 | 4,28 | + | + | + | 0,11 | 344,1 | 1,19 | 0,1 | ||
| −23,34 | 0,31 | 0,53 | 7,75 | + | + | + | 0,22 | 344,7 | 1,84 | 0,07 | |
| 15,32 | 0,23 | 4,86 | + | + | 0,11 | 344,8 | 1,88 | 0,07 | |||
| 0,54 | 0,55 | 0,99 | 1 | 0,27 | 0,39 | 0,91 |
Landscape composition
The analysis was conducted for both 500 m and 250 m radius buffers.
Using landscape composition variables in 250 m buffers, four models were supported (Table 5). These models included crop percentage, permanent crop percentage, and settlement percentage. The most important variable was the percentage of permanent crops and its interaction with species (RVI>0.70; p = 0.05). Settlement percentage was also important among models (RVI =0.72), but not statistically significant.
List of plausible models performed with multi-model inference for landscape composition in 250 m buffer.
he estimates are reported: the intercept (Int), the variables considered in each model (crp_250 = percentage of surface area occupied by crops; prm_250 = percentage of surface area occupied by permanent crops; stt_250 = percentage of surface area occupied by settlements), R2, AIC, ΔAIC and model weight (wi). Relative Variable Importances values and significance are shown in bold.
| (Int) | crp_250 | prm_250 | stt_250 | spcs | crp_250:spcs | prm_250:spcs | stt_250:spcs | R2 | AIC | delta | weight | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 32.16 | 0.96 | −0.46 | + | + | 0.36 | 345.3 | 0 | 0.29 | ||||
| 27.81 | 1.01 | + | + | 0.30 | 345.3 | 0.06 | 0.28 | |||||
| 34.72 | 0.92 | −0.73 | + | + | + | 0.37 | 345.6 | 0.38 | 0.24 | |||
| 90.76 | −0.77 | −1.4 | + | + | + | 0.38 | 346 | 0.75 | 0.20 | |||
| 0.44 | 0.8 * | 0.72 | 1 | 0.28 | 0.71 * | 0.43 |
Considering landscape composition variables within 500 m buffers, three models were supported (Table 6). These models included crop percentage, permanent crop percentage, and settlement percentage. The most important variable was the percentage of permanent crops and its interaction with species (RVI>0.89; p = 0.05).
List of plausible models performed with multi-model inference for landscape composition in 500 m buffer.
The estimates are reported: the intercept (Int), the variables considered in each model (crp_500 = percentage of surface area occupied by crops; prm_500 percentage of surface area occupied by permanent crops; stt_500 = percentage of surface area occupied by settlements), R2, AIC, ΔAIC and model weight (wi). Relative Variable Importances values and significance are shown in bold.
| (Int) | crp_500 | prm_500 | stt_500 | spcs | crp_500:spcs | prm_500:spcs | stt_500:spc | R2 | AIC | delta | weight | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 24,08 | 1,25 | + | + | 0,31 | 343,9 | 0 | 0,25 | |||||
| 29,18 | 1,14 | -0,38 | + | + | 0,35 | 344,8 | 0,95 | 0,15 | ||||
| 0,96 | 0,34 | 1,49 | + | + | 0,34 | 345,1 | 1,26 | 0,13 | ||||
| 0,47 | 0,94* | 0,51 | 1 | 0,21 | 0,89* | 0,21 |
Overall model
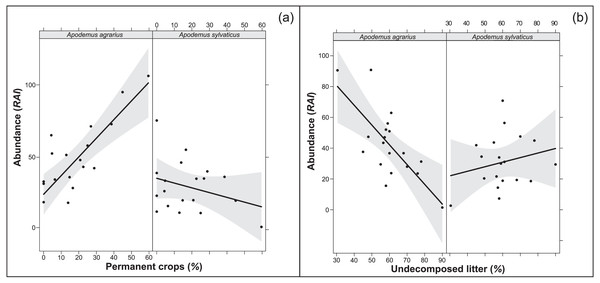
The multi-model inference applied to the selected variables from each environment structural level (overall model) showed one supported model both in 250 m and 500 m buffers (Tables 7, 8). The models confirmed the importance of the extension of permanent crops and the undecomposed litter layer, highlighting a significant interaction of the study species with the variables (p < 0.001; RVI>0.7). In particular, where the landscape had a higher percentage of permanent crops, the abundance of A. agrarius increased, whereas the abundance of A. sylvaticus decreased (Fig. 1A). Instead, an increase of undecomposed litter favors A. sylvaticus, decreasing the abundance of A. agrarius (Fig. 1B). The models including variables within the 250 and 500 m buffers explained respectively 56 and 51% of the total variation in small mammals abundance.
List of plausible models performed with multi-model inference in 250 m buffer.
The estimates are reported: the intercept (Int), the variables considered in each model (prm_250 = percentage of surface area occupied by permanent crops; spcs = species; und = undecomposed litter percentage), R2, AIC, ΔAIC and model weight (wi). Relative Variable Importances values and significance are shown in bold.
| (Int) | prm_250 | spcs | und | prm_250:spcs | spcs:und | R2 | AIC | delta | weight | |
|---|---|---|---|---|---|---|---|---|---|---|
| 20,68 | 0,1873 | + | -0,267 | + | + | 0,56 | 214,8 | 0 | 0,748 | |
| 0,73*** | 0,91. | 0,81*** | 0,7*** | 0,75*** |
List of plausible models performed with multi-model inference in 500 m buffer.
The estimates are reported: the intercept (Int), the variables considered in each model (prm_500 = percentage of surface area occupied by permanent crops; spcs = species; und = undecomposed litter percentage), R2, AIC, ΔAIC and model weight (wi). Relative Variable Importances values and significance are shown in bold.
| (Int) | prm_500 | spcs | und | prm_500:spcs | spcs:und | R2 | AIC | delta | weight | |
|---|---|---|---|---|---|---|---|---|---|---|
| 101,5 | 1,267 | + | -1,295 | + | + | 0,51 | 336,9 | 0 | 0,904 | |
| 0,99*** | 1 | 0,97** | 0,98** | 0,91* |
Figure 1: Relationships between population abundance, species and their interactions with environmental variables (A: permanent crops; B: undecomposed litter).
Relationships between population abundance, species and their interactions with environmental variables, calculated with the best fitting model chosen within Multi-model inference. (A) Permanent crops. (B) Undecomposed litter. Permanent crops = proportion of area covered by permanent crops (poplars, orchards) in buffer area of 250 m around the sampling plot; undecomposed litter = mean percentage of undecomposed litter in the litter stratum. Confidence intervals (95%) are also shown.
Discussion
Our findings shed new light on the interplay between different ecological scales in determining small mammals abundance and distribution. We found species with different ecological niches to differ significantly in landscape and habitat features, suggesting the occurrence of alternative strategies for species coexisting in fragmented forest patches in agricultural landscapes.
Considering the contribution of each variable group and their selection, we found both landscape composition and microhabitat features to significantly affect species abundance, with contrasting species responses. On the contrary, wood structure did not directly influence the abundance of the two studied species, not confirming previous studies evidencing significant relationships between abundance of small mammal forest species and forest tree density (Capizzi & Santini, 2007) and size (Capizzi, Battistini & Amori, 2003). Albeit not significant, our results also highlighted positive relationships between small mammal abundance and tree density, as well as number of tree species and number of shrub species, that could be interpreted as direct relationship with the complexity of the ecological niche. Several studies reported a strong relationship between deadwood abundance and the presence of small mammals. In fact, deadwood represents a source of potential shelters and hosts large invertebrate communities which are potential sources of food (Amori et al., 2015; Bellocq & Smith, 1997; Bowman et al., 2000; Harmon et al., 1986; Kemper & Bell, 1985; McCay, 2000; Miller & Getz, 1977; Szymañski et al., 2020; Tallmon & Mills, 1994; Yahner, 1986). Several studies also indicate that the decay stage may be important in habitat selection of small mammals (Bowman et al., 2000; McCay, 2000). Availability of understory cover is also a key condition for small mammals (Barry, Botje & Grantham, 1984; Bellocq & Smith, 1997; Carey & Harrington, 2001; Cox, Dickman & Cox, 2000; Marsh & Harris, 2000; Simonetti, 1989). Probably its importance is connected with food availability and the related possibility to reduce either the areas of predation (Bellocq & Smith, 1997; Miller & Getz, 1977; Simonetti, 1989) or the competition, by expanding the available space (Montgomery, 1980). Regarding microhabitat structure, the bare soil cover, presence of deadwood and litter structure are known to affect small mammal populations (Amori et al., 2015; Cox, Dickman & Cox, 2000; Denny et al., 2021; Kemper & Bell, 1985; Marsh & Harris, 2000; Simonetti, 1989; Yahner, 1986). Our results confirmed these findings, but highlighted the pivotal role of the litter decomposition stage. Litter decomposition rate is driven by environmental conditions, chemical composition of soil and intensity of soil organism activity (Aerts, 1997; Harmon et al., 1986).
The speed and degree of degradation of leaves depends mainly on the species of tree (He et al., 2019; Mathews & Kowalczewski, 1969; Nykvist, 1962) and other environmental variables such as temperature and humidity. In addition, the presence of large invertebrates such as earthworm, millipedes and other taxa is also relevant, enhancing the degradation of organic matter (Bocock, 1964; Mathews & Kowalczewski, 1969; Tresch et al., 2019). The dynamics of the soil degradation process is connected to invertebrate biodiversity: well developed temperate woodland soils can host up to a hundred species of animals (Anderson, 1975; Tresch et al., 2019). Moreover, leaf litter quality affects numerous trophic levels such as insects, other invertebrates (Koivula et al., 1999; Sabo, Soykan & Keller, 2005) and small mammals (Canova & Fasola, 1991; Hansson, 1978; Kaminski et al., 2007). Litter cover affects the use of habitat by black rats (Cox, Dickman & Cox, 2000), which spend most of the time foraging on the ground, probably obtaining food from the litter (Cox, Dickman & Cox, 2000).
A dense litter cover would produce suitable mesic conditions in soil and litter ensuring appropriate microenvironments for litter-dwelling arthropods used as food (Yahner, 1986). Wood mice catch and find invertebrate prey, which are an important source of food, under litter cover (Piper, Lewis & Compton, 2014). The microclimate conditions of the litter can influence movements of small mammals, whom sounds are more difficult to hear in moist than in dry litter, influencing predation (Vickery & Bider, 1981). Predation risk is considered one of the most important factors determining selection of microhabitat in small mammals (Bellocq & Smith, 1997; Fragoso, Santos-Reis & Rosalino, 2020; Simonetti, 1989).
Despite this evidence, we found a different interaction of the two considered species with the environment conditions. In fact, abundance of A. agrarius was inversely related with the percentage of undecomposed litter, while the opposite trend was observed in A. sylvaticus.
Probably A. agrarius is more dependent on litter quality because it generally avoids xeric conditions, as reported by Yahner (1986) for other species in relation to the moisture of the habitat. This species is known to prefer habitats with dense soil cover and it usually moves through the litter stratum because of its fossorial behaviour (Kuncová & Frynta, 2009), probably to escape predators (Orlandi & Paolucci, 2004).
On the contrary, A. sylvaticus occurs in both woody and in open habitats (Heroldová et al., 2007) avoiding cut crops or cut set aside (Tattersall et al., 2001) and bare soil (Tew, Todd & Macdonald, 2000), showing this species is poorly influenced by the structure of litter, in disagreement with what is reported in other studies (e.g., Balestrieri et al., 2017).
Moreover, A. sylvaticus is apparently not affected by wood characteristics probably because this ubiquitous species prefers the diversity of the complex mosaic created by agricultural landscape rather than the continuous forest habitat (Geuse, Bauchau & Boulengé, 1985; Kozakiewicz et al., 1999).
It is well known that composition of landscape can influence the population dynamics of small mammals (Fischer & Schröder, 2014; Silva, Hartling & Opps, 2005). Our results confirmed this evidence pointing out the positive role of some non-natural habitats (i.e., permanent crops) in agreement with what was found in other studies (Fitzgibbon, 1997; Macdonald et al., 2007; Tattersall et al., 1999; Vieira et al., 2009). Even though some studies showed small mammal abundances to be related with landscape structure (Fischer, Thies & Tscharntke, 2011; Kozakiewicz et al., 1999; Macdonald et al., 2007; Van Apeldoorn et al., 1992; Vieira et al., 2009), in our study, no significant relationship emerged considering landscape configuration. We observed a positive relationship between the abundance of A. agrarius and the presence of permanent crops, despite the percentage of natural woods was relatively low in the studied area (ca. 8% on average). This result suggests that permanent woody crops, such as poplars and orchards, may be important habitats for the study species, especially if placed in the surroundings of woodlots, offering canopy cover and in some cases a dense leaf litter. On the contrary, we did not observe such strong relation for A. sylvaticus, which seems less influenced by the presence of permanent crops in the landscape but with a negative relationship. It seems that A. sylvaticus in Mediterranean areas uses mostly nests positioned far away from orchards, probably to avoid predation (Rosalino et al., 2011), although other studies show that the species is quite common in poplar plantations (Balestrieri et al., 2017) and orchards (Dickman & Doncaster, 1987).
The differences found for the two species could be linked to their ecological requirements.
Our results suggest that A. agrarius, a species connected to the presence of wood mosaic, uses permanent plantations in highly modified landscapes probably as surrogate of forest habitats. The abundance of this species was negatively related with the amount of arable land so that it becomes absent in very simplified landscapes (Fischer, Thies & Tscharntke, 2011). Then, permanent crops could become an important secondary habitat for this rodent in intensive agricultural landscapes.
A. sylvaticus, instead, has a broad ecological niche and can exploit many different habitats (Halle, 1993; Michel, Burel & Butet, 2006), such as fallow lands (Heroldová et al., 2007; Macdonald et al., 2007) and crops (see for instance Tattersall et al., 2001). This species has high dispersal abilities (Marsh & Harris, 2000) and is supposed to have higher abilities to navigate in crops (Sozio, Mortelliti & Boitani, 2013).
In cultivated landscapes, A. sylvaticus moves from hedgerows to crop fields according to seasons (Ouin et al., 2000). At the time of the crop, wood mice massively overrun the fields and remain there until the time of ploughing (Heroldová et al., 2007); during winter more mice are found in field edges than in the center of fields, and when the crop are cut down they prefer hedgerows, woodland edges (Macdonald et al., 2000; Tattersall et al., 2001), woods and fallow lands (Tew & Macdonald, 1993). This allowed them, to avoid predation, which can bring high rates of mortality (Tew & Macdonald, 1993). The wood mouse is therefore well represented in intensified sites because it certainly benefits from landscape heterogeneity as it can find and exploit many resources (Michel, Burel & Butet, 2006). As observed by Bellows, Pagels & Mitchell (2001) for other rodent species, the lack of relations between the species and microhabitat characteristic is probably because of its ability to exploit a variety of sources.
We did not observe significant relationships between species abundance and percentage of settlements in the surroundings, within the considered buffers. This fact may be interpreted as the low presence of urban areas, reduced in the study sites to a few scattered agglomerates of buildings (ca 8.5% in a 500 m buffer).
Conclusions
Our findings revealed that, in the study areas, landscape composition rather than landscape configuration significantly affect small mammals species in the considered agricultural landscapes, which, along with microhabitat features and species interaction, drives species abundance.
Our results showed that composition of agricultural landscapes is not perceived by all species in the same way. Species respond to each ecological scale in relation to their own ecological requirements, spatial behaviors, mobility, and dependency on habitat (Kozakiewicz et al., 1999; Serafini, Priotto & Gomez, 2019). The maintenance of wider woodlots (or hedgerows) is, hence, necessary for several aims, as: (i) protecting wildlife species with different ecological needs, (ii) maintaining/enhancing habitat continuity, and (iii) avoiding structure simplification (Dondina et al., 2016). Functional connectivity among habitat patches is proven to be one of the most important factors affecting the presence of small mammals in urban areas (Fitzgibbon, Putland & Goldizen, 2007) but also matrix composition and management is fundamental since forest species can cross agricultural surroundings (Mortelliti et al., 2013; Paise, Vieira & Prado, 2020). Our results showed that the presence of anthropogenic habitats in the landscape with plausible landscape connectivity functions (such as permanent plantations) can also affect small mammals.
Studies have been carried on connectivity in the agricultural matrix, but the effect of forest plantations on functional connectivity has received limited attention (Mortelliti, Westgate & Lindenmayer, 2014).
Permanent tree crops, especially those aimed at producing woody biomass, have a negative effect on biodiversity when they replace native forest vegetation (Brockerhoff et al., 2008; Greene, Martin & Wigley, 2019). It is already commonly believed that their effect may have less impact than that of the agricultural matrix, since they are working as a semi-permeable barrier for organisms, representing a compromise between maintaining the economic value of an area and reducing the effect of habitat fragmentation, increasing connectivity (Norton, 1998; Brockerhoff et al., 2008; Vanbeveren & Ceulemans, 2019). Landscape connectivity as well as the habitat function, could greatly increase if management rules are properly applied (Norton, 1998; Lindenmayer, Hobbs & Salt, 2003; Zitzmann, Reich & Schaarschmidt, 2021). This process may guarantee, for example, the permanence of mature plants within plantations (Hanowski, Niemi & Christian, 1997) or increase the shrub and herbaceous layers (Moser et al., 2002), whose positive effect on small mammals is already known (Balestrieri et al., 2017). Even the understory cover and litter can promote biodiversity, if they are not completely eliminated (Christian et al., 1997; Christian et al., 1998; Moser et al., 2002; Vanbeveren & Ceulemans, 2019).
Our results showed that several properties of agricultural land mosaics had a strong influence on small mammal abundance, and all of them are within the reach of farmers management. In this study, we get new insight to support the concept of ‘wildlife-friendly farming’ (Fischer et al. 2014), which emphasizes the ecological interactions of farmed and unfarmed coexisting areas and the improvement of natural and cultivated areas as strategy for an agricultural landscape management aimed to increasing biodiversity. This would contribute to the implementation of policy for the conservation of agricultural landscape at local and regional scales, and to farm landscape design.
Supplemental Information
Source de l’article